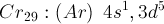Konfigurasi elektron yaitu tata letak elektron dalam atom. Penataan elektron dalam atom memiliki beberapa peraturan yaitu:
- Azas aufbau
Kata aufbau berasal dari bahasa jerman yang berarti "membangun". Azas aufbau menyatakan bahwa penulisan konfigurasi elektron dimulai dari yang lebih rendah kemudian ke yang lebih tinggi. Cara pelnulisannya adalah dengan cara coret miring seperti pada gambar dibawah.
Maka diperoleh urutan sebagai berikut:
1s,2s,2p,3s,3p,4s,3d,4p,5s,4d.
Coba perhatikan 4s dengan 3d, 5s dengan 4d. Orbital pada 4s dan 5s lebih rendah dari 3d dan 4d.
- Menyingkat penulisan konfigurasi elektron dengan menggunakan gas mulia
Contoh: C (Z = 6): 1s², 2s², 2p² disingkat menjadi → (He) 2s², 2p²
- Pengisian kulit d
Pada pengisian subkulit d akan cenderung penuh (10 elektron) atau setengah penuh (5 elektron), meskipun hal ini menyalahi azas aufbau namun inilah cara untuk menyetabilkan subkulit d
Contoh:
Maka untuk menyetabilkan kulit 3d dengan setengah penuh atau penuh ditambah 1 elektron dari 4s menjadi:
- Elektron ion
Elektron ion yang bermuatan a akan cenderung melepas elektron sebanyak a+, dan ion yang bermuatan a- akan cenderung menerima elektron sebanyak a.
Contoh:
karena melepas elektron maka
Home » pengisian kulit d » Konfigurasi elektron dan cara penulisannya